-
Atomes/molécules
L'atome : la base de la base.
 Voici la définition qui est vraiment simple :
Voici la définition qui est vraiment simple :ATOME : est une particule élémentaire d'un corps chimique qui forme la plus petite quantité qui peut se combiner.
C'est un constituant fondamental de la matière.
Un corps constitué d'atomes de même espèce est appelé corps simple ou élément chimique.
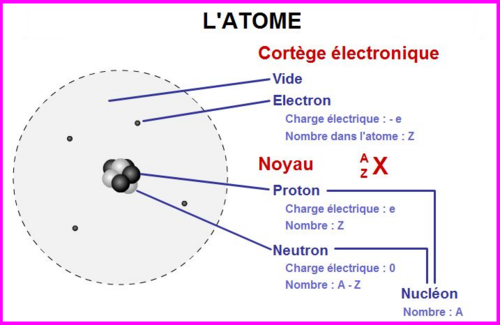
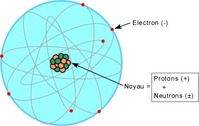
Un atome est composé :
- d'un noyau de nucléons : protons et neutrons concentrant pratiquement toute la masse de l'atome
- des électrons minuscules, orbitant très loin du noyau.
Taille de l'atome : de l'ordre de 10 puissance -10 m
Le plus petit atome est celui d'hydrogène : 1 seul proton, 1 électron.
NUCLÉON :
Il forme le noyau atomique . Il est composé de protons et de neutrons.
En gros Nucléon = (Protons +) + (Neutrons -) formant tout 2 le noyau de l'atome.
PROTON : Sa charge électrique est positive +, l'inverse de celle de l'électron. Le nom proton vient du grec et signifie "le premier", c'est en effet une des premières particules à avoir été identifiée.
NEUTRON : Sa charge électrique est nulle.
ELECTRON :
Particule chargée d'électricité négative qui constitue la partie externe de l'atome. Elle gravite autour du noyau. L'électron a une charge électrique négative de -1,6 x 10 puissance -19 C, qui est la charge électrique élémentaire (on dit donc que sa charge est -1 eV).
Et le Ion alors ? On l'oublie ? ...
ION :
Atome ou molécule ayant gagné ou perdu un ou plusieurs électrons.
Une perte d'électron(s) correspond à une charge globale positive : on parle d'un cation.
Un gain d'électron(s) correspond à une charge globale négative : on parle d'un anion.
Conclusion :
L'atome est une particule, une molécule (c'est pareil) et a une charge normale. Sa composition :
NOYAU (appelé Nucléon) = Proton de charge + et Neutron de charge 0
EXTÉRIEUR DU NOYAU : Electron de charge -
Ion : c'est un atome avec un (ou des) électron(s) en plus ou avec un (ou des) électron(s) en moins. Un ion est donc un atome instable.
En savoir plus Ici
Bonus Savoir : Liaison covalente
Une liaison covalente est une liaison chimique dans laquelle 2 atomes partagent 2 électrons (1 électron chacun ou 2 électrons venant du même atome) d'une de leurs couches externes afin de former un doublet d'électrons liant les 2 atomes. C'est une des forces qui produit l'attraction mutuelle entre atomes.
La liaison covalente implique généralement le partage équitable d'une seule paire d'électrons, appelé doublet liant. Chaque atome fournissant un électron, la paire d'électrons est délocalisée entre les 2 atomes. Le partage de 2 ou 3 paires d'électrons s'appelle respectivement « liaison double » et « liaison triple ».
Au contraire des liaisons toniques où les atomes sont liés par attraction coulombienne non-directionnelle, les liaisons covalentes sont fortement directionnelles. En conséquence, les molécules liées par covalence tendent à adopter des formes caractéristiques possédant des angles de liaison spécifiques.
Une liaison covalente est une liaison dans laquelle 2 électrons de valence sont partagés entre 2 non métaux. Dans ce type de liaison, il doit y avoir une différence d’électronégativité inférieure à 1,7 sur l’échelle de Pauling. Il y a formation d’une liaison covalente (sauf pour les liaisons de coordinence), lorsqu’il y a un recouvrement de 2 orbitales atomiques ayant chacune un électron de valence. Grâce à ce recouvrement, il y aura la formation d’une seule et unique orbitale commune comme le montre la figure (ici). Ce recouvrement d’orbitales atomiques conduit à la formation d’une orbitale moléculaire (non-illustrée). Il y a un partage d’électrons entre 2 atomes d'hydrogène afin de former une seule molécule de dihydrogène. Cette liaison covalente est présentée comme étant : H–H.
Quand ça arrive, ça explose.

-
Commentaires